Para más información sobre la solución EDC de Viedoc, contáctanos en info@sofpromed.com
Los ensayos clínicos oncológicos son complejos y requieren el uso de herramientas electrónicas de recogida de datos (EDC, por sus siglas en inglés de Electronic Data Capture) eficaces para garantizar una recopilación, limpieza y análisis de datos de alta calidad.
Como CRO experta en oncología, Sofpromed ha adoptado la solución EDC de Viedoc para gestionar datos clínicos en estudios oncológicos de fase I-IV, especialmente en el área de tumores sólidos (por ejemplo, sarcomas de tejidos blandos, cánceres ginecológicos, entre otros).
Viedoc ha potenciado y agilizado enormemente los servicios de gestión de datos y programación estadística centrados en oncología de Sofpromed, aumentando el valor de lo que se ofrece a los promotores de ensayos clínicos que desarrollan medicamentos contra el cáncer.
¿Por qué es el EDC de Viedoc un software ideal para ensayos oncológicos?
Veamos 13 razones.
- $1. Recogida precisa de datos sobre la eficacia de fármacos
- $2. Recogida precisa de los datos de seguridad de los fármacos
- $3. Gestión de datos para estudios oncológicos de cualquier fase y dimensión
- $4. Configuración fácil y rápida del estudio
- $5. Una interfaz atractiva para introducir datos
- $6. Una herramienta muy intuitiva y fácil de usar
- $7. Un flujo de trabajo guiado para diferentes roles de estudio
- $8. Compatibilidad con tablets electrónicas
- $9. Panel de métricas potente en tiempo real
- $10. Capacidades de revisión y limpieza de datos
- $11. Funciones de aleatorización
- $12. Exportación de datos en diferentes formatos
- $13. Cumplimiento total de las normas internacionales de regulación y protección de datos
1. Recogida precisa de datos sobre la eficacia de fármacos
El EDC de Viedoc permite la implementación de formularios específicos de la enfermedad para recoger con precisión los datos sobre la eficacia de los fármacos que suelen aparecer en los ensayos oncológicos. Por ejemplo, en los estudios de tumores sólidos, se requiere un formulario de evaluación tumoral para recopilar información acerca de la evaluación radiológica obtenida a través de TACs y resonancias magnéticas. En estos ensayos, suelen llevarse a cabo pruebas radiológicas al inicio del estudio y cada 6 u 8 semanas para medir el tamaño del tumor (según los criterios RECIST) y su densidad (según los criterios Choi). Esto se hace para evaluar la respuesta radiológica del tumor (respuesta completa, respuesta parcial, estabilización o progresión), que indica si la masa tumoral se ha reducido, ha crecido o permanece igual. La fecha de progresión tumoral (crecimiento o aparición de nuevas lesiones) se utiliza para medir la supervivencia libre de progresión (SLP). Además, la supervivencia global (SG) es otro criterio importante de valoración en relación con la eficacia que se mide utilizando formularios de seguimiento de la supervivencia.
2. Recogida precisa de los datos de seguridad de los fármacos
Las toxicidades relacionadas con los fármacos son muy importantes en los ensayos oncológicos y, en particular, en los estudios de escalada de dosis de fase 1, en los que la seguridad del fármaco es uno de los principales criterios de valoración. Mediante el uso del EDC de Viedoc, se pueden implementar fácilmente formularios de eventos adversos para registrar los eventos adversos emergentes del tratamiento (TEAE, por sus siglas en inglés de treatment-emergent adverse events) —vinculados a los medicamentos concomitantes correspondientes, si los hubiera— que se pueden clasificar de acuerdo con los Criterios Terminológicos Comunes para Eventos Adversos (CTCAE, por sus siglas en inglés de Common Terminology Criteria for Adverse Events), un estándar del Instituto Nacional del Cáncer de EE.UU.
3. Gestión de datos para estudios oncológicos de cualquier fase y dimensión
El software EDC de Viedoc es una herramienta flexible y cómoda para la recogida y gestión de datos en ensayos clínicos oncológicos de cualquier fase (1, 2 o 3), así como en estudios observacionales o retrospectivos. Además, es posible utilizarla para crear registros de cáncer regionales, nacionales o internacionales. El sistema es escalable y capaz de gestionar no sólo las necesidades específicas de los pequeños estudios en fase temprana centrados en la seguridad, sino también el gran número de pacientes y centros necesarios en ensayos internacionales de modalidad pivotal o de registro.
4. Configuración fácil y rápida del estudio
El paquete EDC de Viedoc se ha diseñado para facilitar la implementación de cuadernos de recogida de datos electrónicos (CRDe) mediante una interfaz de configuración del estudio muy intuitiva. Esto permite a los gestores de datos crear formularios de datos de forma rápida y sin esfuerzo, acortando así los plazos de configuración del CRDe para los promotores.
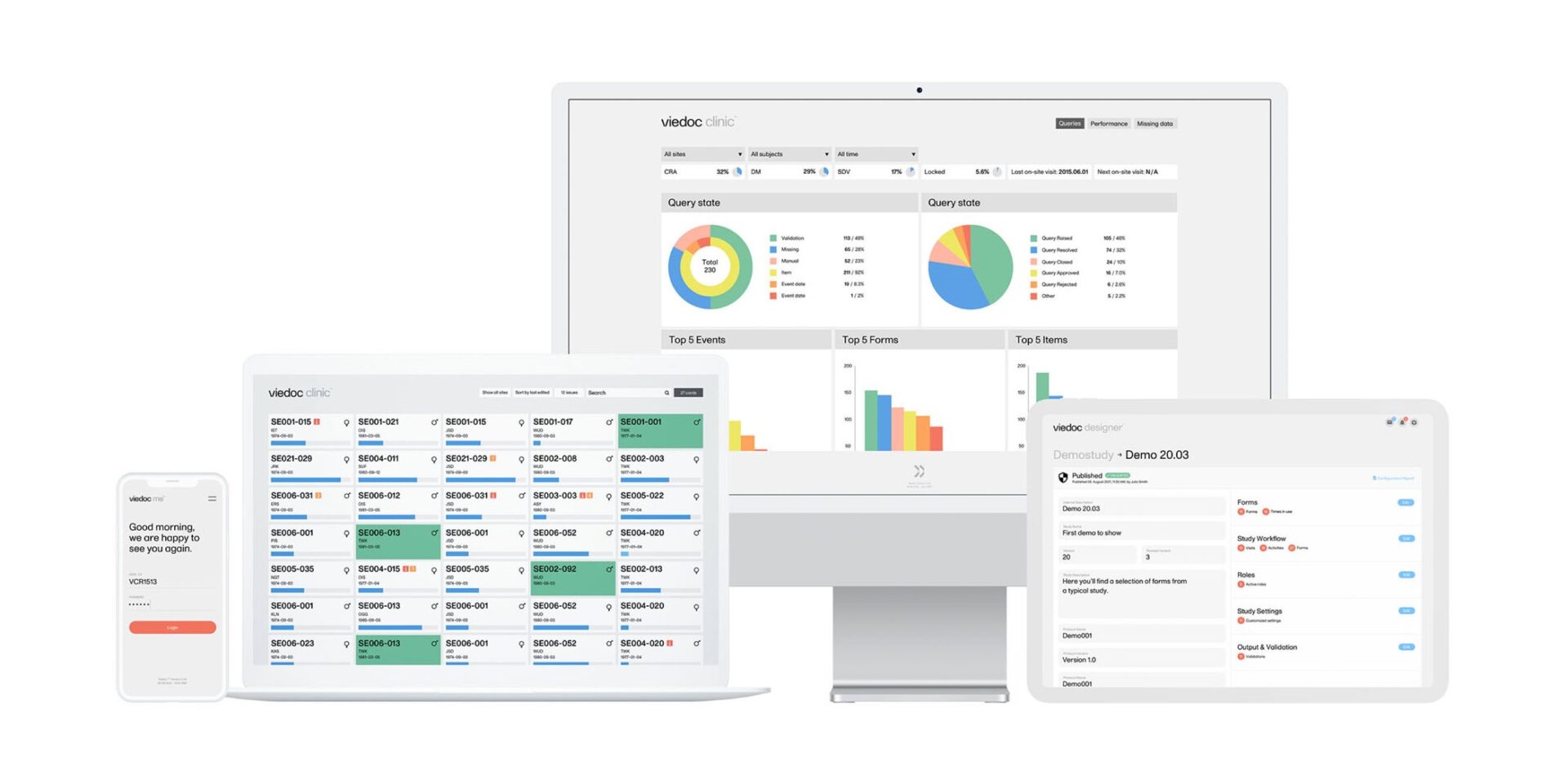
5. Una interfaz atractiva para introducir datos
Una característica única del sistema EDC de Viedoc es su magnífico aspecto. Los coordinadores de estudios y el personal de registro de datos de los centros valorarán el hecho de poder utilizar la plataforma clara y atractiva de Viedoc, que hará más agradables sus tareas diarias de inserción de datos y resolución de incidencias o queries.
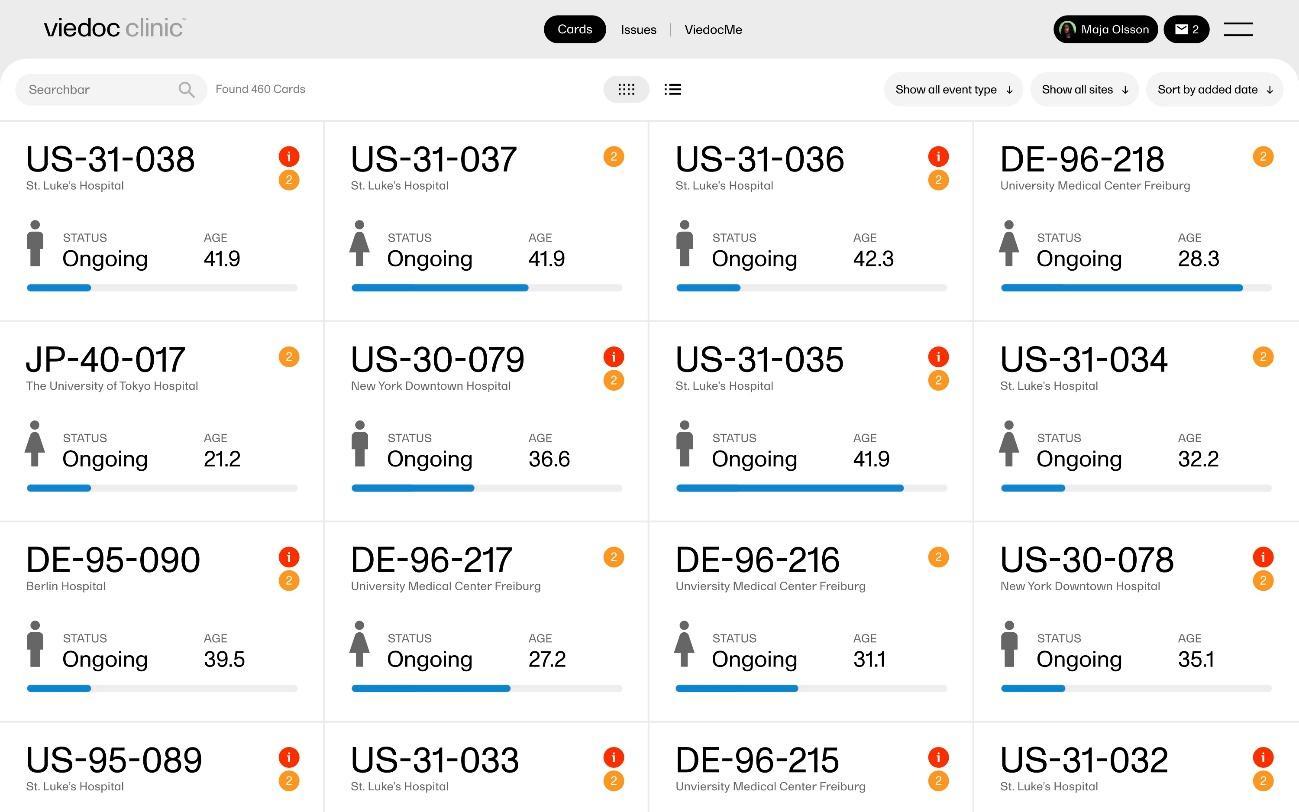
Figura 1: Vista de la lista de pacientes en el CRDe de Viedoc
6. Una herramienta muy intuitiva y fácil de usar
El software EDC de Viedoc destaca por su diseño intuitivo y su facilidad de uso inigualable. Su diseño inteligente facilita la vida de los usuarios, que pronto se darán cuenta de lo fácil que es navegar por los formularios para introducir datos y resolver queries. La claridad y la simplicidad son el núcleo del ecosistema de Viedoc.
7. Un flujo de trabajo guiado para diferentes roles de estudio
El software de Viedoc permite una variedad de roles de usuario (por ejemplo, investigador, gestor de datos, monitor) y proporciona mensajes de ayuda útiles para cada rol específico, lo cual facilita la navegación y las tareas de estos usuarios. Cada persona recibe instrucciones a la largo de la gestión de las firmas en un formulario, la resolución de queries y la cumplimentación de datos que faltan, entre otras tareas.
8. Compatibilidad con tablets electrónicas
Uno de los valores añadidos del EDC de Viedoc es su compatibilidad con múltiples dispositivos, incluidas las tablets electrónicas. El personal del hospital y los pacientes (cuando los resultados los notifican los pacientes, ePRO) disfrutarán de la interfaz adaptada a estos dispositivos de EDC de Viedoc para su uso sobre la marcha. En lo que respecta a los ensayos sobre cáncer, el uso de tablets adquiere relevancia en los ensayos ePRO porque los pacientes registran datos sobre su calidad de vida, el dolor y la información sobre el uso de analgésicos.
9. Panel de métricas potente en tiempo real
Teniendo en cuenta que los datos completos y precisos son fundamentales para el éxito de los ensayos clínicos, la plataforma EDC de Viedoc proporciona un potente panel de métricas en tiempo real para llevar a cabo un seguimiento de los diferentes parámetros del estudio a diferentes niveles: de centro, de país o de estudio. Entre otros aspectos, esto permite realizar un seguimiento del número y estado de las queries.
10. Capacidades de revisión y limpieza de datos
La solución EDC de Viedoc integra buenas funciones de revisión de datos y gestión de queries que aceleran el proceso general de limpieza de datos. Por ejemplo, el sistema permite la gestión de queries basada en funciones y los supervisores pueden llevar a cabo una verificación selectiva de los datos de origen (SDV, por sus siglas en inglés de Source Data Verification) a nivel de elemento. El bloqueo de datos puede ejecutarse a nivel de formulario, visita, paciente y estudio.
11. Funciones de aleatorización
El EDC de Viedoc es la herramienta de software perfecta para gestionar ensayos oncológicos aleatorizados. El sistema permite la creación de tablas de aleatorización predefinidas y listas generadas dinámicamente. Mediante el uso de un módulo adicional (Viedoc Logistics), las funciones de gestión de suministros del ensayo pueden integrarse completamente en el sistema EDC para controlar también la asignación de fármacos del estudio.
12. Exportación de datos en diferentes formatos
El EDC de Viedoc facilita el trabajo de los programadores estadísticos, proporcionando las exportaciones de datos en Excel, CSV, SAS, PDF / A (compatible con las solicitudes a la FDA, eCTD), y formatos CDISC ODM. Las exportaciones de datos se pueden realizar manualmente en cualquier momento, y se pueden preprogramar.
13. Cumplimiento total de las normas internacionales de regulación y protección de datos
El conjunto de herramientas del software de Viedoc cumple plenamente las normas del sector, incluidos los requisitos normativos de la FDA, la EMA, la JPMA y la CFDA, así como las leyes de protección de datos, como la GDPR (Europa), la APPI (Japón), la HIPAA (Estados Unidos) y la PISS (China). Además, el software contiene un módulo de auditoría de datos y gestiona las firmas electrónicas de acuerdo con la FDA 21 CFR parte 11.
Conclusión
La gestión de los datos clínicos en los estudios oncológicos puede suponer un reto, y los promotores de los ensayos deben utilizar herramientas EDC eficaces para garantizar una recogida, depuración y análisis de datos oportunos y precisos. Como CRO experta en oncología, Sofpromed puede proporcionar servicios de gestión de datos y programación estadística de alta calidad basados en las potentes funciones de la suite Viedoc EDC a un coste asequible.
Para más información sobre la solución EDC de Viedoc, contáctanos en info@sofpromed.com